Por MV Lucas Sara, Servicios Veterinarios para Ceva Salud Animal Cono Sur
Los adenovirus aviares son los agentes etiológicos de enfermedades conocidas como la hepatitis por cuerpos de inclusión y el síndrome de hepatitis-hidropericardio. En la actualidad, estas infecciones generan enfermedades que resultan en pérdidas económicas importantes a la avicultura industrial en diversos países y regiones a nivel global.
La Hepatitis por Cuerpos de Inclusión (HCI) es una enfermedad vírica, de curso agudo, que afecta a las aves comerciales. Fue descrita por primera vez por Helmboldt y Frazier en el Estado de Connecticut en los Estados Unidos de América en el año 1963. A partir de la segunda mitad de los años 1960 la enfermedad comenzó a ser diagnosticada cada vez con mayor frecuencia en varias partes del mundo (Alemnesh et al., 2012). En el año 1987, a partir de un brote de hepatitis e hidropericardio que generó grandes pérdidas económicas en empresas avícolas de Paquistán se la denominó “Enfermedad de Angara”. En la actualidad, la enfermedad se encuentra extendida mundialmente en diferentes zonas y regiones del mundo.
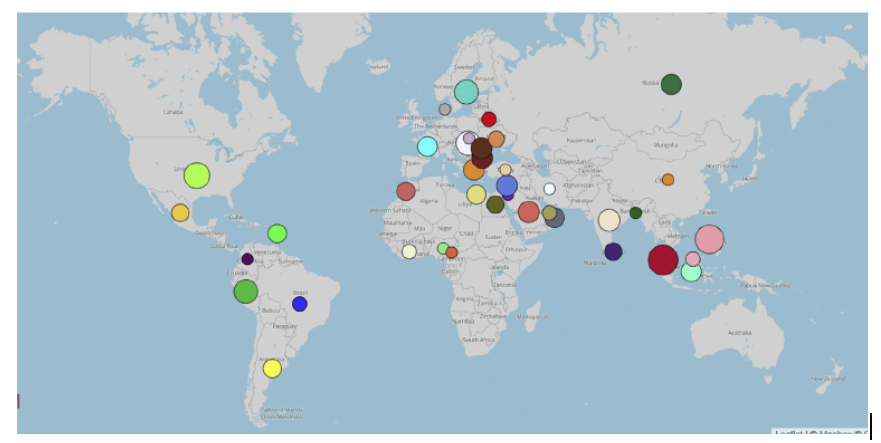

Los brotes de Hepatitis por cuerpos de inclusión han sido reportados en varios países de América Latina como Brasil, Chile, Perú, Ecuador, México (Rahimi et al.,2015) y Argentina.
La Hepatitis por Cuerpos de Inclusión (HCI) está causada por el Grupo I de Adenovirus aviares (King et al., 2012). Este grupo de FAdV (del inglés Fowladenovirus) se ha asociado a diferentes entidades clínicas, aunque también pueden ser aislados de animales sanos. Históricamente, el virus era considerado un agente infeccioso secundario, pero actualmente existen evidencias para concluir que, en diversos casos puede tratarse de un agente primario en ausencia de enfermedades concomitantes (De la Torre, 2018).
Los cuadros producidos por FAdV-I incluyen:
- Hepatitis por Cuerpos de Inclusión.
- Síndrome de hepatitis-hidropericardio.
- Erosiones en molleja.
- Alteración de los índices de conversión.
El agente causal es un Aviadenovirus del Grupo I (FAdV-I) que se clasifica en 5 especies (o (grupos moleculares de Zsac y Kisary) y 12 serotipos (ICTV: Comité internacional sobre taxonomía viral), a saber:
- FAdV A: serotipo 1
- FAdV B: serotipo 5
- FAdV C: serotipos 4 y 10
- FAdV D: serotipos 2, 3, 9 y 11.
- FAdV E: serotipos 6, 7, 8a y 8b.
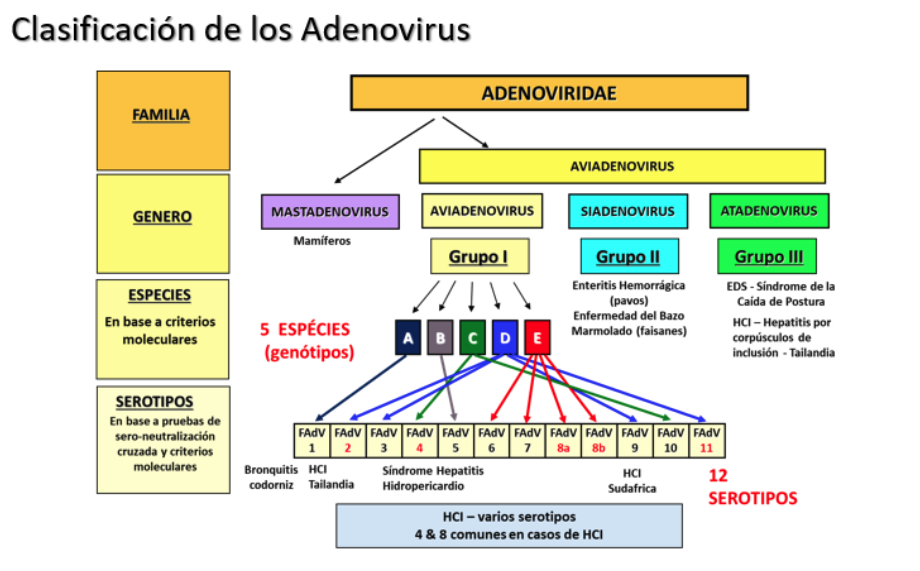

A su vez, dentro de cada serotipo se pueden identificar diferentes patotipos virales.
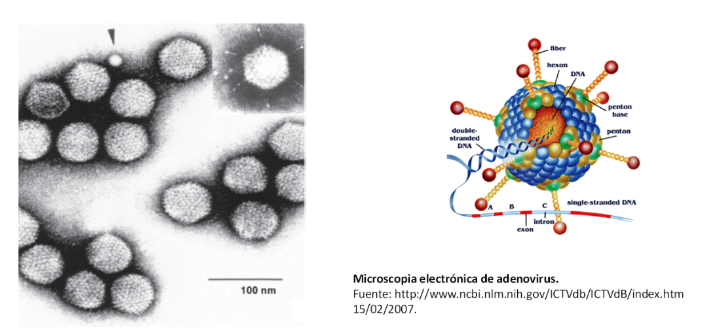
El agente causal es un virus ADN de doble cadena, sin envoltura que replica en el núcleo de las células infectadas formando cuerpos de inclusión intranucleares.

La transmisión del virus puede producirse por:
- Vía vertical: a partir de reproductoras que se infectan en fase de postura que transmiten el virus a la progenie por un periodo de 2 a 4 semanas. Si bien la enfermedad es completamente asintomática en las reproductoras, la descendencia presenta signos, lesiones y mortalidad, en general durante los primeros días de edad hasta los 21 días aproximadamente.
- Vía horizontal: se produce en aves susceptibles sin anticuerpos maternos específicos del serotipo. El virus está presente en el tracto gastrointestinal, mucosa nasal y traqueal, riñón y es eliminado por todas las secreciones, semen y heces (título más alto). El cuadro clínico, las lesiones y la mortalidad aparecen luego de las 3 semanas de edad y las aves aumentan la resistencia a las consecuencias de la enfermedad conforme avanza la edad.
Con relación a la transmisión del virus, es importante destacar el fenómeno de latencia viral donde luego de la infección inicial, el virus a veces puede quedar latente en unos cuantos individuos del lote y puede reactivarse en períodos de estrés como el inicio de puesta, problemas de manejo, reiniciando el proceso de transmisión vertical.
Por otro lado, en múltiples casos se han descripto brotes de HCI como consecuencia de coinfecciones con agentes inmunodepresores como la enfermedad de Gumboro, Anemia Infecciosa Aviar o la presencia concomitante de agentes no infecciosos inmunosupresores como las intoxicaciones con micotoxinas y el estrés por calor.





Características de la enfermedad
Con frecuencia, los FAdV se aíslan de aves aparentemente sanas, las infecciones pueden ser asintomáticas o asociadas con varias afecciones clínicas y patológicas de acuerdo con los factores descriptos previamente. Inicialmente se evidencia un aumento repentino de mortalidad, con un pico a los 4-6 días del inicio y que suele durar 9-14 días (Hafez, 2011).
Los signos que caracterizan a las aves afectadas son:
- Postración
- Anorexia
- Plumas erizadas
- Morbilidad generalmente baja.
La mortalidad puede variar entre un 2 a 40% dependiendo de los serotipos y patotipos involucrados, de la presencia de factores inmunosupresores concomitantes y las condiciones de alojamiento y manejo.
Si bien existen antecedentes de cuadros clínicos por FAdV que ocasionan HCI en aves de líneas livianas, suele afectar comúnmente a líneas pesadas.
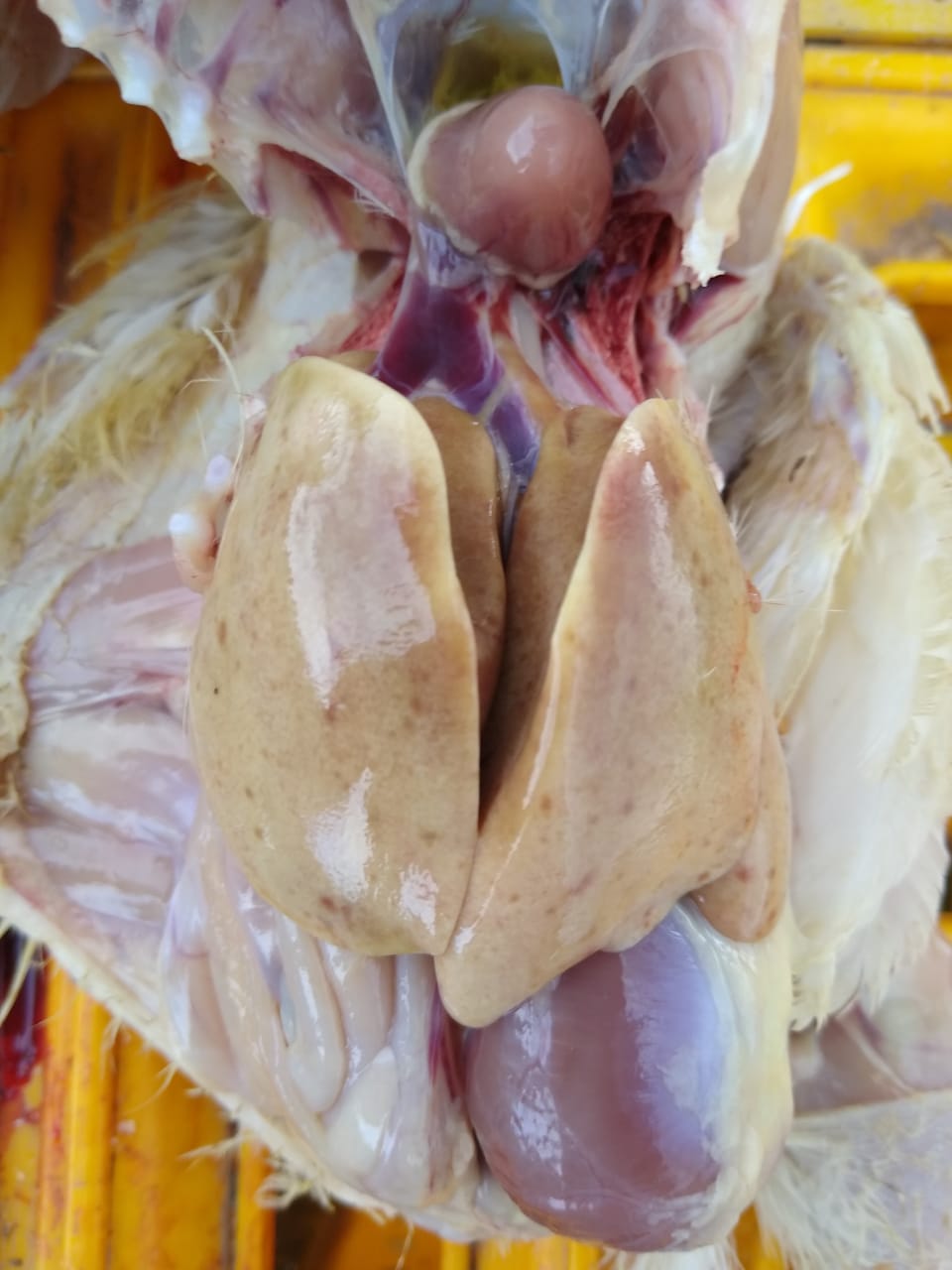
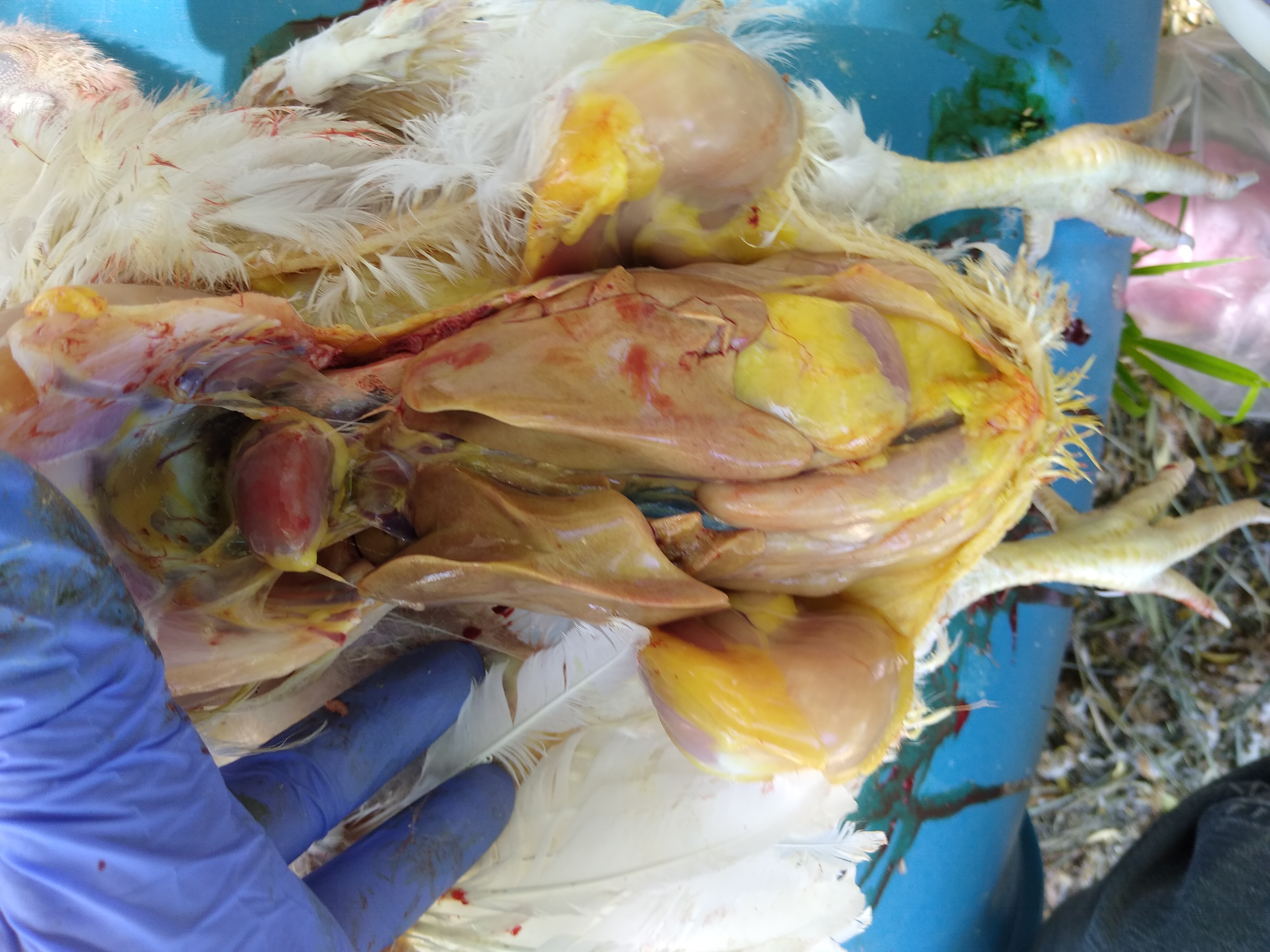
Las lesiones macroscópicas características son:
- Hepatomegalia.
- Hígado pálido y friable.
- Hemorragias petequiales o equimóticas
- Hidropericardio en los casos de infecciones por FAdV-serotipo 4.
- Tumefacción y palidez renal
- Esplenomegalia
A nivel microscópico, los hallazgos más comunes son:
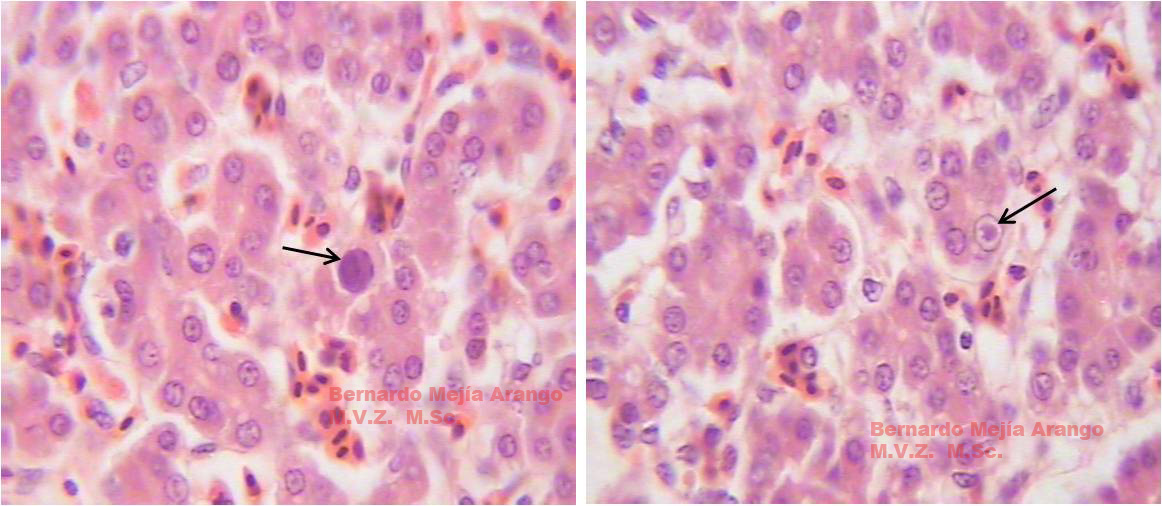
- Hepatitis necrotizante multifocal
- Cuerpos de inclusión intranucleares (Cowdry tipo A) eosinófilos o en ocasiones basófilos en hepatocitos y células pancreáticas y del bazo característicos y diagnósticos de la enfermedad.
La presencia de cuerpos de inclusión intranucleares en el hígado, páncreas y bazo es una clara evidencia de la replicación de adenovirus en estos sitios. Los cambios degenerativos causados por el FAdV en el bazo y la bolsa de Fabricio, órganos que son importantes para la respuesta inmunitaria tanto celular como humoral, además del agotamiento del sistema inmunitario de la mucosa en el tracto respiratorio, aumentan la posibilidad de infección con otros patógenos aviares (Radwan et al., 2018).
Adicionalmente a la histopatología donde es posible identificar las lesiones y cuerpos de inclusión específicos (Itakura et al., 1974), otras herramientas disponibles para el diagnóstico el diagnostico son la serotipificación y le genotipificación viral. En relación a las pruebas serológicas, las pruebas diagnósticas disponibles son neutralización viral, la inmunofluorescencia indirecta, pero en la práctica son escasamente utilizadas debido a las limitantes operativas y el costo de estas pruebas (Schachner et al., 2014). Por otro lado, existen diferentes ensayos de ELISA, pero en este caso la limitante es que, si bien permiten detectar la presencia de anticuerpos frente a FAdV-I, no es posible diferenciar y caracterizar los serotipos involucrados con los kits comercialmente disponibles.
En relación a las pruebas de diagnóstico molecular, la prueba de PCR (del inglés, polymerase chain reaction) es un método que se ha utilizado para la detección de infecciones por adenovirus aviares por su alta sensibilidad, simplicidad, selectividad y rapidez. El producto de la PCR del gen hexón se secuencia directamente, y la información resultante se puede utilizar para identificar el grupo y el tipo de adenovirus aviar que está infectando a las aves (Li et al 2017). De hecho, la PCR es el método de elección para la identificación directa de FAdV (Vaillancourt, 2011).
El correcto diagnóstico clínico y de laboratorio para la detección de cuadros clínicos asociados a hepatitis por cuerpos de inclusión y la ejecución de programas de monitoreo epidemiológico consistentes y robustos son esenciales para determinar el o los serotipos involucrados en cada país o región y establecer programas de control adecuados a los desafíos existentes.


